Molaridad
¿Qué es?
Es la unidad de concentración se basa en el volumen de una solución y por ello es conveniente utilizarla en los procedimientos del laboratorio en donde la cantidad medida es el volumen de solución. La molaridad se define como el número de moles de soluto por litro de solución (también como el número de milimoles de soluto por mililitro de solución).
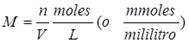
en donde M es la molaridad, n es el número de moles de soluto y V es el volumen de solución expresado en litros. Ya que:
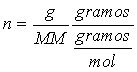
en donde g representa los gramos de soluto y MM la masa molecular del soluto, de aquí que:
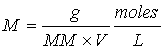
Cuando se da la información de la concentración de una especie química en moles por litro esto se indica poniendo la fórmula de la especie dada entre corchetes. Por ejemplo, [H+] = 0.1 nos indica que la concentración de H+ es de 0.1 moles/litro.
Tratándose del equilibrio químico, es necesario distinguir entre la concentración analítica que no es más que el número total de moles de un soluto en un litro de solución y la molaridad analítica de una especie en equilibrio. Por ejemplo, si añadimos 0.1 moles de ácido acético a un litro de agua, tendremos una concentración analítica de ácido acético 0.1 molar. Sin embargo en virtud del equilibrio:
una fracción de las moléculas de ácido acético estará ionizada por lo que la concentración real de la especie CH3COOH será menor que 0.1 molar.
Algunos reactivos de mucha aplicación en análisis químico son manufacturados en estado líquido como una disolución concentrada de la sustancia de interés. Entre estas sustancias tenemos la mayoría de los ácidos que con mayor frecuencia se utilizan en los laboratorios como son el ácido sulfúrico, clorhídrico, etc. En los frascos de estos ácidos concentrados nos indican los fabricantes su porcentaje (% masa/masa) y densidad de la solución del ácido. Con estos datos podemos calcular el volumen necesario del ácido concentrado para preparar un ácido más diluido. Para ello nos basamos en la masa de reactivo necesaria para preparar la solución es igual a la masa que encontramos de ese reactivo en una solución concentrada. Por ejemplo para una solución diluida cuya concentración se da en forma de molaridad:
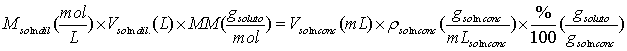
En general la ley de conservación de la masa, en este caso particular aplicada a las soluciones, nos exige que el número de moles al preparar una dilución de una solución se mantenga constante y esto se expresa por:
EJEMPLOS
1.Calcule la molaridad de una solución que contiene 6.00 g de NaCl (MM 58.44) en 200 ml de solución.
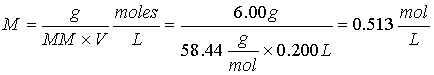
2.Cuántos mililitros de H2SO4 concentrado al 95% (r = 1.84 g/mL) se necesitarán para preparar 2.5 l de solución 2 M de este ácido.
El número de gramos de H2SO4 necesarios será:
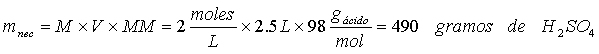
en cada mL de H2SO4 hay:
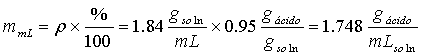
Y la cantidad de mL necesarios será:
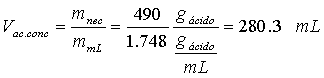
Es importante no confundir moralidad y molalidad. La molalidad refiere a la cantidad de moles de soluto en kilogramo de solvente (Molalidad=Número de moles de soluto/ Masa de disolvente)
La Molaridad. al estar vinculada al volumen de disolución, depende de la presión y de la temperatura. Por eso, al cambiar la presión o la temperatura, también se modifica el volumen y por lo tanto , la molaridad. Esto no le ocurre con la molalidad,que se puede medir con más precisión.
Para evitar este inconvenientes es frecuente que, a la hora de trabajar con la molaridad, se recurra a factores o coeficientes que permitan corregir la temperatura.
Elaborado por:
equipo N°5
bibliografias
- https://www.quimicas.net/2015/05/ejemplos-de-molaridad.html
- https://definicion.de/molaridad/
- http://www.sabelotodo.org/quimica/molaridad.html

La molaridad es una unidad de concentración del volúmen aun que prefiero más la normalidad
ResponderBorrarLa molaridad nos sirve para saber el volumen de una solución para poder prepararla , nos sirvió mucho en esta unidad ya que la utilizamos y la seguimos utilizando con frecuencia
ResponderBorrarEste comentario ha sido eliminado por el autor.
ResponderBorrarEs muy importante saber hacer los problemas de molaridad ya que con ellos podemos saber el volumen de una solución
ResponderBorrarEs muy buena esta información ya que nos ayuda a saber como sacar la molaridad de una solución y eso a nosotros nos conviene saberlo ya que somos químicos.
ResponderBorrarCastillo Don Juan Diana Gpe.
ResponderBorrarMuy buena información al dar los aspectos que afectan a la molaridad ya que estos si No se toman en cuenta puede que se hagan malos cálculos de la molaridad.También es muy buena la explicación de las diferencias entre molaridad y molalidad, en donde en la primera se refiere al número de moles de soluto en un litro de solución , mientras que en la segunda interviene el Kg.
CASTILLO DON JUAN JOHANA GUADALUPE.
ResponderBorrarLa información presentada es muy buena ya que se menciona de forma clara el concepto de molaridad (M),la cual nos ha sido de mucha ayuda durante el semestre para determinar el volumen de una sustancia para la preparación de soluciones así como su concentración.
Mariana Acosta Toledo
ResponderBorrarLa molaridad es una unidad de medida la cual nos ayuda para saber o determinar el volumen y concentracion de las sustancias para la elaboracion de soluciones
Me pareció muy interesante e importante esta información ya que nos permite conocer un poco más acerca de la molaridad que nos ayuda a determinar el volumen y concentración de las sustancias
ResponderBorrarEs una muy buene información que nos ayuda a saber sobre la molaridad ya que aporta ejemplos que nos enseña como sacar la molaridad y su definición es muy precisa y asi podemos tener un conocimiento mas claro de esto.
ResponderBorrarLo envio Nicole Michelle Castro Fernández.
BorrarEsta información nos ayuda a conocer que es la molaridad y cómo se aplica ya que nos muestra diversos ejemplos de esto.
ResponderBorrarCon esta información pudimos enriquecer los conocimientos que generamos durante el semestre recordando como la molaridad se utiliza para cuantificar la concentración de soluto y otros cálculos relacionados con la molaridad
ResponderBorrarCervantes Adán María Guadalupe.
ResponderBorrar-Esta información nos brinda la definición y ejemplos sobre lo que es la molaridad y la manera de determinarla. Así mismo es una muy buena información, ya que nos da una pequeña retroalimentación respecto a lo que vimos a lo largo del semestre.
La molaridas es la concentración de moles que existe por litro en una solución. Se define como la relación que existe entre el numero de moles y el volumen de la solución. Y se pude representar como "M=n/v" Apartir de esta también se puede determinar el volumen de una solución a partir de la molaridad, despejando la formula.
ResponderBorrar-Luitin Esteban Dalia Itzeidith
Borrar