https://1drv.ms/p/s!Ar5LtUNjznNegRWBY73rma5hfmAQ
MANEJO Y ALMACEN DE REACTIVOS (Laboratorio A 103)
Trataremos el tema sobre la clasificación de los reactivos, referente a la materia de Química, así como los daños al medio ambiente, que éstos pueden producir. Realizado por alumnos del Centro de Bachillerato Tecnológico industrial y de servicios No. 103
lunes, 10 de junio de 2019
Técnicas de Separación y Purificación con base a Procedimientos Estandarizados (Equipo 7)
MÉTODOS FÍSICOS DE SEPARACIÓN Y PURIFICACIÓN DE SUSTANCIAS ORGÁNICAS
INTRODUCCIÓN
Cuando se quiere conocer la composición de una sustancia
orgánica es necesario seguir tres etapas básicas.
Obtener una muestra representativa de la muestra.
Separar o aislar cada una de las sustancias componentes de la
mezcla para su posterior análisis.
La segunda de las etapas es una de las más complejas,
laboriosas y difícil de realizar
El conocimiento de los métodos de aislamiento y purificación
de un compuesto es fundamental en Química Orgánica por las
siguientes razones:
• Poder determinar su estructura
• En los procesos de síntesis.
• Seguimiento de las reacciones químicas
Estos métodos están basados en las diferencias que existen
entre las propiedades físicas de los componentes de una mezcla
(puntos de ebullición, densidad, presión de vapor,
solubilidad, etc.)
Los métodos de separación explicados en esta entrada serán los siguientes:
Filtración, Decantación, Cristalización, Sublimación, Destilación, Extracción y Cromatografía
FILTRACIÓN
Se conoce como filtración a una técnica para separar sólidos en suspensión dentro de un fluido (líquido o gas), empleando para ello un medio filtrante: un sólido poroso que pasa a denominarse tamiz, filtro o criba. Este filtro retiene los sólidos de mayor tamaño y permite el paso del fluido, junto con las partículas de tamaño inferior.
Consiste en retener partículas sólidas suspendidas de un
líquido o un gas forzando la mezcla a través de una barrera
porosa que puede ser mallas, fibras, material poroso o un
relleno sólido.
FILTRACIÓN POR SUCCIÓN
La filtración a vacío o por succión se utiliza para mezclas
como barros y pastas.
El agua al pasar a través de la trompa, en el estrechamiento
interior, aumenta su velocidad originando una disminución de
presión. Esto origina una succión del aire a través de la
conexión con el matraz, originando un pequeño vacío en éste.
También se emplea para separar los cristales obtenidos a
partir de una disolución.
DECANTACIÓN
 La decantación es una técnica que permite separar un sólido mezclado heterogéneamente con un líquido en el que es insoluble o bien dos líquidos inmiscibles (que no se pueden mezclar homogeneamente) con densidades diferente.
La decantación es una técnica que permite separar un sólido mezclado heterogéneamente con un líquido en el que es insoluble o bien dos líquidos inmiscibles (que no se pueden mezclar homogeneamente) con densidades diferente.
CRISTALIZACIÓN
Proceso de separación de un soluto a partir de su disolución,
por sobresaturación de la misma, aumento de la concentración o
por enfriamiento de esa disolución.
La cristalización permite separar solutos prácticamente puros.
CRISTALIZACIÓN POR EVAPORACIÓN
Esta es la otra opción para lograr la
precipitación de los cristales de soluto, haciendo uso de un proceso de
evaporación de solvente (a temperatura constante, a diferencia del método
anterior), para hacer así que la concentración de soluto sobrepase el nivel de
solubilidad.
SUBLIMACIÓN
Es el paso de una sustancia del estado sólido al gaseoso sin
pasar por el estado líquido. Se puede considerar como una
forma especial de destilar una sustancia sólida.
La temperatura de sublimación es aquella a la cual la presión
de vapor del sólido iguala a la presión externa.
Para que una sustancia sublime debe tener una elevada presión
de vapor, es decir, las atracciones intermoleculares en estado
sólido deben ser débiles
Cuanto menor sea la diferencia entre la presión externa y la
presión de vapor de una sustancia más fácilmente sublimará.
La sublimación es un método excelente para la purificación de
sustancias relativamente volátiles.
Ejemplos: la desaparición de la nieve, sin fundir, en un día
de invierno frío pero soleado, el dióxido de carbono sólido,
la naftalina y el yodo que subliman a la temperatura
ambiente.
DESTILACIÓN
La separación y purificación de líquidos por destilación
constituye una de las principales técnicas para purificar
líquidos volátiles. La destilación hace uso de la diferencia
entre los puntos de ebullición de las sustancias que
constituyen una mezcla.
 Las dos fases en una destilación son la vaporización o
transformación del líquido en vapor y la condensación o
transformación del vapor en líquido. Existen varios tipos de
destilaciones. La elección en cada caso se hace de acuerdo con
las propiedades del líquido que se pretenda purificar y de las
impurezas que lo contaminan.
Las dos fases en una destilación son la vaporización o
transformación del líquido en vapor y la condensación o
transformación del vapor en líquido. Existen varios tipos de
destilaciones. La elección en cada caso se hace de acuerdo con
las propiedades del líquido que se pretenda purificar y de las
impurezas que lo contaminan.
El método físico consiste en suministrar calor a la mezcla
logrando que el líquido de menor punto de ebullición se
vaporice en primer lugar y luego se produzca la condensación
de ese vapor al ponerlo en contacto con una superficie fría.
DESTILACIÓN SIMPLE
Técnica utilizada en la purificación de líquidos cuyo punto de
ebullición es inferior a 150ºC a la presión atmosférica.
Útil para eliminar impurezas no volátiles
También sirve para separar dos líquidos con puntos de
ebullición que difieran en al menos 25 ºC.
DESTILACIÓN A VACÍO O PRESIÓN REDUCIDA
Técnica usada en la separación de líquidos con un punto de
ebullición superior a 150 ºC.
Como un líquido hierve cuando su presión de vapor iguala la
presión atmosférica, se puede reducir su punto de ebullición
disminuyendo la presión a la cual se destila
Para mantener una ebullición homogénea se puede usar plato
poroso o adaptar al conjunto un capilar para mantener la
ebullición homogénea.
DESTILACIÓN FRACCIONADA
Técnica que se utiliza en la separación de sustancias cuyos
puntos de ebullición difieren entre sí menos de 25ºC.
La diferencia con la destilación simple es que incorpora una
columna de fraccionamiento (o de rectificación) entre la
disolución y el refrigerante.
La columna de fraccionamiento consta de un tubo largo de
vidrio que lleva en su interior un relleno inerte (hélices de
vidrio) o unos platos de condensación.
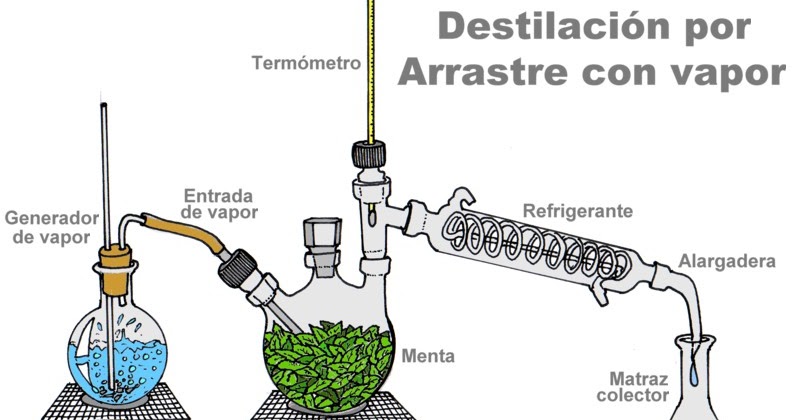
DESTILACIÓN EN CORRIENTE DE VAPOR
Al hacer pasar una corriente de vapor a través de la mezcla,
ambos componentes se destilan juntos.
Como el agua y el compuesto son inmiscibles, cada uno de
ellos ejerce su presión de vapor independientemente del otro
(al contrario que en la destilación simple)
EXTRACCIÓN
Se aplica a todo tipo de mezclas ya sean sólidas, líquidas o
gaseosas.
Está fundamentada en la diferencia de solubilidades de los
compuestos.
CROMATOGRAFÍA
Se entiende por cromatografía al conjunto de técnicas
analíticas que se fundamentan en la separación que se produce
cuando una mezcla de compuestos es arrastrada por una fase
móvil a lo largo de una fase estacionaria.
La técnica cromatográfica de purificación consiste en separar
mezclas de compuestos en función de su diferente afinidad
entre una fase estacionaria y una móvil.
CLASIFICACIÓN DE LOS PROCESOS CROMATOGRÁFICOS
La fase móvil puede ser un líquido o un gas. La fase
estacionaria puede ser un sólido o un líquido.
Teniendo en cuenta la naturaleza de la fase estacionaria se
establece la siguiente clasificación.
 CROMATOGRAFÍA DE ADSORCIÓN: la fase estacionaria es un sólido
sobre el que se adsorben los componentes de la muestra.
CROMATOGRAFÍA DE ADSORCIÓN: la fase estacionaria es un sólido
sobre el que se adsorben los componentes de la muestra.
- Cromatografía Líquido – Sólido CLS (fase móvil líquido)
- Cromatografía Gas – Sólido CGS (fase móvil gas)
- Cromatografía en Capa Fina CCF
(fase estacionaria sólida en forma plana y la móvil
líquida)
CROMATOGRAFÍA DE REPARTO: la fase estacionaria es un líquido
sostenido por un sólido inerte.
- Cromatografía Líquido – Líquido CLL (fase móvil un
líquido)
Fase Móvil
Fase Estacionaria
Soluto - Cromatografía Gas – Líquido CGL (fase móvil un gas)
- Cromatografía en papel (fase estacionaria es una capa de
agua adsorbida sobre una hoja de papel)
CROMATOGRAFÍA DE INTERCAMBIO IÓNICO: la fase estacionaria es
una resina de intercambio iónico y la separación se produce
por la unión de los iones a la fase estacionaria.
CROMATOGRAFÍA DE EXCLUSIÓN MOLECULAR: la fase estacionaria es
una estructura parecida a un tamiz y la separación se produce
en función del tamaño de las moléculas.
Teniendo en cuenta la forma de la fase estacionaria se
clasifica en:
- Cromatografía en columna
- Cromatografía plana (cromatografía en capa fina y en
papel.
Por: Equipo 7 - 2AVQ
domingo, 9 de junio de 2019
NORMALIDAD (EQUIPO 6)
NORMALIDAD
¿QUÉ ES?
La Normalidad:
La Normalidad (N) o Concentración Normal de una disolución es el número de Equivalentes Químicos (EQ) o equivalentes-gramo de soluto por litro de disolución:
Normalidad (N) = nº EQ (equivalentes-gramo)
Litros de disolución
EQUIVALENTE QUIMICO
Un equivalente químico se define según el tipo de reacción que estemos estudiando.
En reacciones ácido-base
- Para un ácido, es igual al número de H+. Por ejemplo, en 1 mol de HNO3 hay 1 mol de equivalentes ya que hay 1 H+ por molécula de ácido nítrico. En cambio, en 1 mol de H2CO3 hay 2 moles de equivalentes, dado que hay 2 H+ por molécula de ácido carbónico.
- Para una base, es igual al número de OH–. Por ejemplo, en 1 mol de Al(OH)3 (hidróxido de aluminio) hay 3 moles de equivalentes.
- Para las sales, es igual al número de carga positiva total (o negativa, ya que son iguales) por mol de la sal. Notemos que, si la sal fue obtenida de una reacción de neutralización, ese número se corresponderá con el número de H+ neutralizados (o de OH– neutralizados), por consiguiente, de moléculas de agua (H2O) producidas. Por ejemplo, el carbonato de aluminio (Al2CO3) está compuesto por 2 cationes Al3+(6 cargas positivas) y 3 aniones CO32- (6 cargas negativas). Por lo tanto, en 1 mol de carbonato de aluminio hay 6 moles de equivalentes.
La Normalidad (N) por lo tanto mide la concentración de una disolución de manera similar a la Molaridad (M). De hecho N = M cuando en los casos anteriores el nº de H+ , OH- o la carga de los iones es igual a 1.
EJEMPLO
Calcular la normalidad y la molaridad de 50 gramos de Na2CO3 en 100 ml de disolución:
Normalidad (N):
Peso molecular del Na2CO3 = 106
Equivalente del Na2CO3 = peso molecular / nº de carga del catión de la sal = 106 / 2 = 53
nº de Equivalentes en 50 g de Na2CO3 = 50 / 53 = 0,94
N = nº de Equivalentes / litros de disolución = 0,94 / 0,1 = 9,4 N
RESIDUOS GENERADOS
Normalmente cuando nosotros preparamos una solución en base con los cálculos de normalidad en nuestro laboratorio las sustancias mas comunes que utilizamos son NaOH, H2SO4 y NaCl, cuando terminamos nuestra solución normalmente la tenemos que desechar pero sabemos que esta nunca se debe de tirar en el lavabo de laboratorio ya que estas sustancias contaminan el agua, así que en laboratorio contamos con envases de desechos, ácidos y bases y ahí nosotros desechamos nuestras soluciones creadas o aveces el maestro las reutiliza para otras practicas de laboratorio.
Fuente: https://www.quimicas.net/2015/05/ejemplos-de-normalidad.html
https://www.lifeder.com/peso-equivalente/
https://quimica.laguia2000.com/general/unidades-de-concentracion-parte-3
PUBLICADO POR EL EQUIPO 6
https://quimica.laguia2000.com/general/unidades-de-concentracion-parte-3
PUBLICADO POR EL EQUIPO 6
martes, 12 de marzo de 2019
CLASIFICACIÓN DE REACTIVOS (EQUIPO 2)
CLASIFICACIÓN DE REACTIVOS DE ACUERDO A SU COLOR
CONCLUSIÓN:
En conclusión, los reactivos químicos se deben almacenar de manera correcta ya que si no se almacena correctamente estos podrían contaminarse y serian peligrosos para su uso, estos se almacenan por colores que son: rojo, amarillo, verde, azul y blanco. Los colores tienen un significado, el rojo significa que las sustancias son inflamables, el amarillo que las sustancias son oxidantes, el azul es un reactivo toxico, el verde es moderadamente toxico y el blanco es corrosivo. Para poder desechar los reactivos después de su uso se tiene que balancear su ph a 7, por ejemplo, si tenemos una base con un ph de 12 se le tiene que agregar un poco de ácido para que como ya mencione el ph baje a 7 y si son ácidos, lo mismo, pero con una base hasta balancearlo, después de que se cumple con estos requisitos se puede desechar en el drenaje, cuando se tiene sustancias que no se pueden desechar de esta forma porque son demasiado peligrosas, se tiene que llamar a una empresa especializada para que se deshagan de estos, así también con los botes que contienen dichas sustancias después de que se juntan un número considerable de esto se llama a la empresa especializada para desecharlos.
Los lugares con demasiados reactivos peligrosos se clasifican como zonas de alto riesgo, como también hay de medio y bajo riesgo. Para un uso correcto de los reactivos se debe tener en cuenta la hoja de seguridad del reactivo, debemos observar el rombo de seguridad.
Blanco Corrosivo. Puede ser nocivo para los ojos las membranas mucosas y la piel. Almacenar separado de sustancias combustibles e inflamables.
Amarillo Reactivo / oxidante. Puede reaccionar violentamente con agua, aire o químicos de otro tipo. Almacenar separado de reactivos combustibles e inflamables.
Rojo Inflamable. Almacenar separadamente sólo con otras sustancias químicas inflamables.
Azul Tóxico. Entraña un riesgo para la salud si se ingiere, inhala o absorbe por la piel. Almacenar por separado en un área segura.
Verde Reactivo, presenta no más que un riesgo moderado en cualquier categoría. Almacenamiento de productos químicos Generales.
Gris: Utilizado por Fisher en lugar de verde. Reactivo presenta no más que un riesgo moderado en cualquier categoría. Almacenamiento de productos químicos Generales.
Naranja: Código de color obsoleto, sustituido por el verde. Reactivo presenta no más que un riesgo moderado en cualquier categoría. Almacenamiento de productos químicos Generales.
Rayas Incompatible: con otros reactivos del mismo código de color. Almacenar separado.
En conclusión, los reactivos químicos se deben almacenar de manera correcta ya que si no se almacena correctamente estos podrían contaminarse y serian peligrosos para su uso, estos se almacenan por colores que son: rojo, amarillo, verde, azul y blanco. Los colores tienen un significado, el rojo significa que las sustancias son inflamables, el amarillo que las sustancias son oxidantes, el azul es un reactivo toxico, el verde es moderadamente toxico y el blanco es corrosivo. Para poder desechar los reactivos después de su uso se tiene que balancear su ph a 7, por ejemplo, si tenemos una base con un ph de 12 se le tiene que agregar un poco de ácido para que como ya mencione el ph baje a 7 y si son ácidos, lo mismo, pero con una base hasta balancearlo, después de que se cumple con estos requisitos se puede desechar en el drenaje, cuando se tiene sustancias que no se pueden desechar de esta forma porque son demasiado peligrosas, se tiene que llamar a una empresa especializada para que se deshagan de estos, así también con los botes que contienen dichas sustancias después de que se juntan un número considerable de esto se llama a la empresa especializada para desecharlos.
Los lugares con demasiados reactivos peligrosos se clasifican como zonas de alto riesgo, como también hay de medio y bajo riesgo. Para un uso correcto de los reactivos se debe tener en cuenta la hoja de seguridad del reactivo, debemos observar el rombo de seguridad.
En el laboratorio “A” se usan con mayor frecuencia el ácido sulfúrico, ácido clorhídrico y el ácido nítrico.
LABORATORIO DE QUÍMICA A (Equipo 3)
“CBTis 103”
Norma en la que se basa el laboratorio

“CBTis 103”
11 marzo 2019 11:43pm
2ªAVQ
Introducción:
El presente proyecto ha sido elaborado con el fin de informar la cantidad de reactivos que se encuentran en el plantel CBTIS 103 y con ello su clasificación en cuanto a la norma en la cual se ha basado su almacenaje dentro de la institución.
Partiendo desde la entrevista realizada al profesor David Navarro, encargado del laboratorio A del plantel, y quien nos recibió de una manera muy gratificante, proporcionándonos la información necesaria para llevar a cabo nuestro proyecto. El tema central del proyecto es la clasificación de almacenaje de las diversas sustancias contenidas dentro del laboratorio de química. Como bien, debemos saber la importancia que tiene el saber con qué reactivos trabajamos a diario dentro del plantel y, ¿qué más que especificarnos en nuestra área?
A continuación y sin más preámbulo, se espera que el lector se vea satisfecho con la siguiente información.
Norma en la que se basa el laboratorio
Considerado de bajo riesgo, el laboratorio del CBTis 103 se basa en la norma de seguridad inglesa NFPA ( http://www.nfpajla.org/~nfpajla/nfpa-en-lationoamerica/nfpa-en-espanol ), la cual consiste en protección en caso de incendio, al igual que se hace la mención de la NOM JKB que establece la autoridad de docentes hacia el alumnado que lleva a cabo su especialidad dentro del laboratorio. Hay un aproximado de 347 reactivos existentes.
El laboratorio cuenta con 10 gavetas en las cuales son almacenados reactivos de acuerdo a su clasificación.
Clasificación de color y almacenamiento
· Blanco Corrosivo. Puede ser nocivo para los ojos las membranas mucosas y la piel. Almacenar separado de sustancias combustibles e inflamables.
· Amarillo Reactivo / oxidante. Puede reaccionar violentamente con agua, aire o químicos de otro tipo. Almacenar separado de reactivos combustibles e inflamables.

· Rojo Inflamable. Almacenar separadamente sólo con otras sustancias químicas inflamables.
· Azul Tóxico. Entraña un riesgo para la salud si se ingiere, inhala o absorbe por la piel. Almacenar por separado en un área segura.
· Verde Moderadamente Peligroso. Presenta no más que un riesgo moderado en cualquier categoría. Almacenamiento de productos químicos Generales.
Desecho de reactivos empleado:
Uno de los métodos más utilizados en el laboratorio para desechar los reactivos, es aquel que consta en separar ácidos y bases en diferentes recipientes una vez se llena el recipiente que contiene ácidos se debe de neutralizar su PH a 7 con ayuda de un medidor, igual es el caso de la base el cual su PH debe neutralizarse a 7 para verterlos al drenaje.
Los reactivos son almacenados en 10 gavetas diferentes conforme a su clasificación de riesgo, una de ellas contiene reactivos contaminados los cuales son intervenidos por una empresa especializada la cual se encarga de detectarlos correctamente para evitar lo mayor posible la contaminación ambiental.
Una vez que los reactivos son neutralizados y valorados por personal capacitado son transformados en gases o en otro tipo de estado de agregación, para posteriormente poderse desechar correctamente en drenajes o liberándose en forma de gas hacia el aire, pero ya no contaminados para evitar de esta manera los efectos de la contaminación; ya que no todos los reactivos se pueden desechar de la misma manera puesto que cada uno cuenta con características diferentes.
🔻
Recomendaciones e información en general sobre el laboratorio
Algunas de las recomendaciones que nos proporciona el profesor David Navarro, encargado del laboratorio, son las siguientes:
· No someter a calor con el mechero de Bunsen a los solventes orgánicos, utilizar parrilla.
· Los desecadores mini son utilizados por su mayor facilidad en cuanto a su manipulación.
· Los desecadores contienen Dióxido de Silicio el cual al saturarse cambia su coloración tornándose de un color transparente. Una vez cambiada su coloración debe someterse al horno para desecación y así poder mantenerlo en su coloración inicial.
🔻
· En caso de salpicadura informar rápidamente a algún docente encargado del laboratorio y/o lava ojos alrededor de 15 minutos y enjuagar en regaderas.
· No se debe tocar ninguna sustancia con las manos para prevenir posibles daños en la piel.
· En caso de quemadura aplicar crema proporcionada por algún docente experto sobre el tema.
conclusión
Para concluir podemos decir que es importante saber qué cantidad de reactivos posee el bachillerato al cual asistimos. Apreciamos la manera correcta de mantener los reactivos ya que en dado caso de que se mantengan juntos y al no ser compatibles pueden generar una reacción bastante fuerte que puede traer consecuencias explosivas o dañinas para el entorno.
Se resaltó que en el área de reactivos es solicitada una campana de extracción ya que al cerrar el área se contienen los gases desprendidos de las sustancias químicas esto en un futuro puede provocar diversas reacciones que hasta ahora no se han producido.
Suscribirse a:
Comentarios (Atom)